
6-丙基-2-萘酚在液晶領域具有重要的研究價值,其經過萘環的氫化、羟基氧化後得到6-丙基-2-萘酮[1],再與帶有不同取代基的芳環偶聯可合成性能優越的新型反式十氫萘類液晶單體(tǐ)。反式十氫萘類液晶具有拓寬混合液晶的工(gōng)作溫度區間、增大(dà)介電各向異性、降低阈值電壓、減小(xiǎo)雙折射率等優越的光電性能[2],适用于TFT型液晶顯示材料,近幾年來正逐步取代環己基類液晶而得到越來越廣泛的應用。
6-丙基-2-萘酚直接或間接地作爲中(zhōng)間體(tǐ),在反式十氫萘類液晶的合成中(zhōng)起着舉足輕重的作用。但是國内外(wài)文獻關于6-丙基-2-萘酚的合成研究暫無相關報道。本文改良性提出了以廉價的2-萘酚爲起始原料,經O-甲基化得到2-甲氧基萘(2),(2)經酰化得到6-丙酰基-2-甲氧基萘(3),(3)經黃鳴龍還原得到6-丙基-2-甲氧基萘(4),(4)經過脫甲基得到目标産物(wù)6-丙基-2-萘酚(5),其結構經 IR、1H NMR、MS分(fēn)析确證。
1 實驗部分(fēn)
1.1 試劑與儀器
2-萘酚(GC>98%)、氫氧化鈉、丙酰氯、氫氧化鉀、三氯化鋁、二甘醇、氫溴酸均爲工(gōng)業品;硫酸二甲酯、水合肼均爲分(fēn)析純;氮氣。
GC-2010氣相色譜儀;GCMS-2010EV質譜儀;Avanceav 500型核磁共振儀(CDCl3溶劑,TMS内标);DZF 6050真空幹燥箱。
1.2 實驗方法
6-丙基-2-萘酚合成路線:
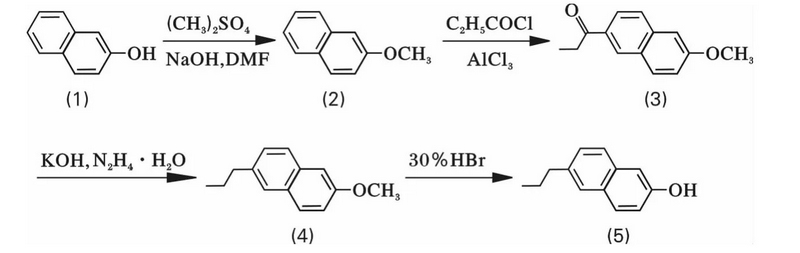
1.2.1 2-甲氧基萘(2)的合成 向通有氮氣的3 L三口瓶中(zhōng),依次加入100 g(0.690 mol)2-萘酚(1),33.3 g氫氧化鈉,500 mL DMF,攪拌溶解至清亮,保持溫度在25℃,緩慢(màn)滴加113.8 g硫酸二甲酯,在此溫度下(xià)攪拌,反應2 h(GC跟蹤),直到2-萘酚反應完全。不斷攪拌下(xià)将反應液緩慢(màn)加入到1 L水中(zhōng),用600 mL×2的二氯甲烷萃取水相,合并有機相。将有機相水洗至中(zhōng)性,無水硫酸鎂幹燥,減壓濃縮後,得類白(bái)色固體(tǐ)粗品,用乙醇重結晶,得到白(bái)色固體(tǐ)産物(wù)107 g(0.677 mol),收率98%,純度 GC 99.6%,m.p.72 ~74 ℃。GC-MS(m/z):(159,M+1)。
1.2.2 6-丙酰基-2-甲氧基萘(3)的合成 向通有氮氣的3 L三口瓶中(zhōng),依次加入150 g(0.948 mol)2-甲氧基萘,1 500 mL二氯甲烷,105.3 g無水三氯化鋁,攪拌溶解,保持溫度在-5~0℃,緩慢(màn)滴加164.6 g丙酰氯,在此溫度下(xià)反應3 h(GC跟蹤),直到2-甲氧基萘反應完全。不斷攪拌下(xià)将反應液緩慢(màn)加入到2 L冰水中(zhōng),用500 mL×2的二氯甲烷萃取,水洗至中(zhōng)性,無水硫酸鎂幹燥,減壓濃縮後,得紅白(bái)色固體(tǐ),用乙醇重結晶,得到白(bái)色固體(tǐ)産物(wù)122.5 g(0.572 mol),收率 60%,純度 GC 99.5%,m.p.111 ~113 ℃。GC-MS(m/z):(215,M+1)。
1.2.3 6-丙基-2-甲氧基萘(4)的合成 向通有氮氣的5 L三口瓶中(zhōng),依次加入229.8 g(1.073 mol)6-丙酰基-2-甲氧基萘,2 L二甘醇,90.1 g氫氧化鉀,80.5 g水合肼,升溫至130~150℃,反應分(fēn)出低沸點物(wù)質,繼續升溫至220~230℃,攪拌、反應1 h(GC跟蹤),直到6-丙基-2-甲氧基萘反應完全。體(tǐ)系降溫後,不斷攪拌下(xià),将反應液緩慢(màn)加入到1 L水和1 L二氯乙烷中(zhōng),用800 mL×2的二氯乙烷萃取,水洗至中(zhōng)性,無水硫酸鎂幹燥,減壓濃縮後,得棕色固體(tǐ)産物(wù)214 g(1.070 mol),收率100%,純度 GC 98%,m.p.52 ~ 55 ℃。GC-MS(m/z):(201,M+1)。
1.2.4 6-丙基-2-萘酚(5)的合成 向通有氮氣的1 L三口瓶中(zhōng),依次加入100 g(0.500 mol)6-丙基-2-甲氧基萘,300 mL氫溴酸,500 mL乙酸,攪拌下(xià)升溫至100℃,攪拌、反應5 h(GC跟蹤),直到6-丙基-2-甲氧基萘反應完全。不斷攪拌下(xià)、将反應液緩慢(màn)加入到1 L水中(zhōng),用1 L×3的二氯乙烷萃取,水洗至中(zhōng)性,無水硫酸鎂幹燥,減壓濃縮後,得棕色固體(tǐ),減壓蒸餾,收集110~130℃/5~10 Pa的餾分(fēn),用乙醇重結晶,得到白(bái)色固體(tǐ)産物(wù)83.5 g(0.449 mol),收率89%,純度GC 99%,m.p.98~101℃。GC-MS(m/z):(187,M+1)。IR(KBr,cm-1):3 284,2 954,2 924,861,816,484。1H NMR(500 MHz,CDCl3):δ 0.96(t,3H,CH3),1.71(m,2H,CH2),2.71(t,2H,CH2),3.89(s,1H,OH),7.09(s,1H,CH),7.12(d,1H,CH),7.23(s,1H,CH),7.28(m,1H,CH),7.53(s,1H,CH),7.65(m,1H,CH)。
2 結果與讨論
2.1 2-萘酚甲基化方法探讨
酚的甲基化方法有很多種,文獻報道多采用濃硫酸催化下(xià)與甲醇反應[3]或和碘甲烷反應實現[4-5],收率爲62% ~92%。而采用硫酸二甲酯甲基化[6-7],室溫反應即可有較高的轉化率,文獻報道采用氫氧化鈉和水的體(tǐ)系,收率普遍較低。經過調整,用DMF取代水作溶劑,收率可達到90%以上,見表1。

表1 不同溶劑體(tǐ)系對2-萘酚反應的影響Table 1 Effect of different solvent system on the reaction of 2-naphthol
由表1可知(zhī),采用水作溶劑,雖然安全,毒性小(xiǎo),但是收率隻能達到62%,而采用DMF替代水,不僅純度高、反應迅速,而且收率較高,後處理方便。
2.2 2-甲氧基萘傅-克酰化的定位研究
2-甲氧基萘的傅-克丙酰基化反應一(yī)般得到兩種異構體(tǐ)2-甲氧基-6-丙酰基萘(3)和2-甲氧基-1-丙酰基萘(3a)的混合物(wù)。
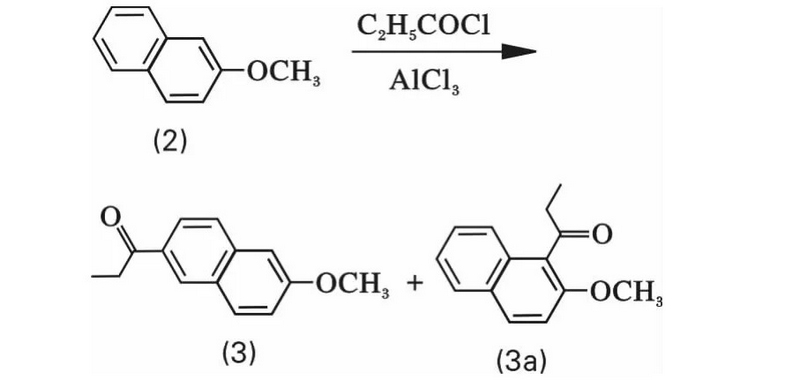
由于酰基和芳環之間存在共轭效應,故酰化産物(wù)穩定,因此與傅-克烷基化不同,傅-克酰基化反應通常認爲是不可逆的。但臨位取代基由于酰基扭曲于芳環平面,無法産生(shēng)共轭效應,因此這一(yī)類的酰基化反應認爲是可逆的。
本文以2-甲氧基萘(2)爲原料,經丙酰化合成6-丙酰基-2-甲氧基萘(3),由于 —OCH3爲活化基團,使得2-甲氧基萘的1位和6位同樣具有反應活性,故反應中(zhōng)會有相當量的副産物(wù)1-丙酰基-2-甲氧基萘産生(shēng)。2-甲氧基-6-丙酰基萘由于産生(shēng)共轭是穩定的,屬于熱力學控制産物(wù),而2-甲氧基-1-丙酰基萘由于酰基和萘環之間不存在共轭效應,因此是不穩定的,在一(yī)定條件下(xià)是有可能轉化爲熱力學穩定的酰化産物(wù)。爲提高2-甲氧基萘6位的酰化産率,文獻報道主要集中(zhōng)在兩個方面:
一(yī)是在2-甲氧基萘的1位引入一(yī)個緻鈍基團[3,8],一(yī)般爲鹵素原子(氯或溴),占據 1 位,從而提高6位酰化産率,但整個反應增加了鹵代和脫鹵兩個階段,增加了反應步驟。
二是在高極性溶劑如硝基苯中(zhōng)進行[9-11]。高極性溶劑有利于6位酰化産物(wù)的生(shēng)成,且硝基苯具有阻止甲基脫落的作用,但整個反應需要使用大(dà)量有毒的硝基苯,反應完畢除去(qù)溶劑也較困難,産品不易分(fēn)離(lí)出來,不利于大(dà)規模工(gōng)業化生(shēng)産。
若采用氯代烷烴作溶劑,不僅廉價易操作,而且在控制反應溫度和反應時間後,能夠較高的得到6位酰化産物(wù)。本文就從反應體(tǐ)系、溫度以及反應時間來考察酰化産物(wù)6-丙酰基-2-甲氧基萘(3)的異構比例。
2.2.1 不同溶劑對2-甲氧基萘反應的影響 -5~0℃時,分(fēn)别用二氯甲烷、硝基苯和二氯甲烷混合體(tǐ)系進行反應,考察反應溶劑對2-甲氧基萘的酰化影響,結果見表2。
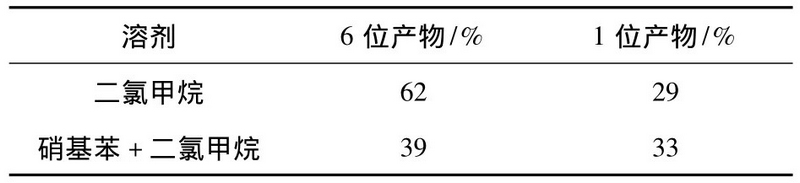
表2 反應溶劑對産物(wù)異構比例的影響Table 2 Effect of reaction solvent on the isomerism proportion of product
由表2可知(zhī),純二氯甲烷體(tǐ)系能得到較大(dà)比例的6位産物(wù),且考慮後處理方便及更經濟環保,采用純二氯甲烷體(tǐ)系進行酰化反應。
2.2.2 反應溫度對2-甲氧基萘反應的影響 以二氯甲烷作溶劑,考察不同反應溫度對2-甲氧基萘酰化反應的影響,結果見表3。

表3 反應溫度對産物(wù)異構比例的影響Table 3 Effect of reaction temperature on the isomerism proportion of product
由表3可知(zhī),低溫有利于6位酰化産物(wù)(3)的生(shēng)成,溫度過低原料轉化率明顯降低,因此選用-5~0℃反應爲最佳。
2.2.3 反應時間對2-甲氧基萘反應的影響 -5~0℃時,以二氯甲烷作溶劑,考察延長反應時間是否有利于酰化産物(wù)(3a)轉化爲酰化産物(wù)(3),結果見表4。

表4 反應時間對産物(wù)異構比例的影響Table 4 Effect of reaction time on the isomerism proportion of product
由表4可知(zhī),此條件下(xià)反應迅速,3 h原料轉化率即可達到90%以上,随着反應時間的延長,并沒有明顯異構(3a)向異構(3)的轉化,說明此類結構的酰化産物(wù)異構比例不是由反應時間決定的。
2.3 6-丙基-2-甲氧基萘脫甲基方法探讨
在有機合成中(zhōng),醚鍵的斷裂一(yī)般是在強質子酸或者強路易斯酸的作用下(xià)完成的。因此,一(yī)般選用氫鹵酸與乙酸溶液共熱[12]或BBr3[13]來脫甲基。由于BBr3見光及受熱易分(fēn)解出有毒氣體(tǐ),遇水、醇易分(fēn)解并會引起爆炸,放(fàng)大(dà)反應時後處理比較危險,故本文采用6-丙基-2-甲氧基萘在HBr-CH3COOH溶液中(zhōng)共沸脫甲基,相比較三溴化硼法來說,反應轉化率高,操作方便,後處理簡單,且危險性大(dà)大(dà)降低。
3 結論
(1)用2-萘酚爲起始原料來合成6-丙基-2-萘酚,總收率爲52.3%,其結構經 IR、1H NMR、MS分(fēn)析确證。
(2)探讨了水和DMF作溶劑時,不同體(tǐ)系對2-萘酚反應結果的影響。用DMF作溶劑時,不僅純度高、反應迅速,而且收率較高,後處理方便。
(3)探讨了反應體(tǐ)系、溫度以及反應時間對酰化産物(wù)6-丙酰基-2-甲氧基萘(3)的異構比例的影響。用二氯甲烷作溶劑,-5~0℃下(xià)反應3 h,6-丙酰基-2-甲氧基萘構型占優勢,原料反應徹底。
(4)用6-丙基-2-甲氧基萘在HBr-CH3COOH溶液中(zhōng)共沸脫甲基,反應轉化率高,操作方便,後處理簡單,且危險性大(dà)大(dà)降低,收率可以達到80%以上。
(5)該方法合成中(zhōng)間6-丙基-2-萘酚,工(gōng)藝簡單,操作簡便,産品的純度好,産率高,具有較好的工(gōng)業應用前景。
(作者/李豔豔,劉骞峰 | 來源/參考網)





